QUIMICA ORGÁNICA:
Definición:
- Química orgánica o química del carbono.
- Todos los compuestos menos el dióxido de carbono y monóxido de carbono son estudiados por la química orgánica
-Estudio de las macromoléculas orgánicas
El carbono
Natural:
* En la naturaleza:
- Si tiene forma (Cristalino)
- Amorfos (No tienen forma)
Artificial:
- El coque
- El negrohino
- El liguito
Importancia:
Es importante porque estudia la base principal de todos los compuestos orgánicos, el carbono: el carbono esta presente en nuestra vida, en la ropa en jabones, en grasas, proteínas, azucares, etc.
Estudio del átomo de Carbono:
1.- Propiedades físicas:
Es sólido a temperatura ambiente.
Puede encontrarse en forma amorfa o cristalina (grafito o diamante.)
2.- Propiedades químicas:
Hibridación:
Es la función de orbitales de diferentes energias del mismo nivel pero de diferente subnivel , resultando orbitales de energía constante y de igual forma.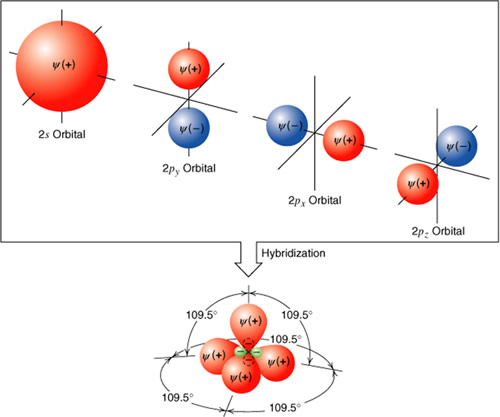
Covalencia:
Esta propiedad consiste en que los 4 orbitales hibridos son de igual intensidad de energia y por lo tanto sus 4 enlaces del carbono son iguales y de igual clase. Esto significa que el carbono ejerce la misma fuerza de unión por sus 4 enlaces , un buen ejemplo seria el del metano.


Auto saturación:
Esta propiedad se define como la capacidad del atomo de carbono para compartir sus electrones de valencia consigo mismo formando cadenas carbonadas , esta propiedad es fundamental en el carbono y lo diferencia de los demas elmentos quimicos . Al compartir sus electrones con otros atomos de carbono puede originar enlaces simples , dobles, o triples de tal manera que cada enlace representa un par covalente y comparten dos y tres pares de electrones.

Tetravalencia :
En 1857 postulo Friedrich Kekulé la tetravalencia en su teoria estructural dicha propiedad del atomo de carbono como dice Mourey, es la guia mas segura en la edificación de la quimica orgánica por lo tanto se acepta que el carbono se manifiesta siempre como tetravalente y sus enlaces son covalentes e iguales entre si.
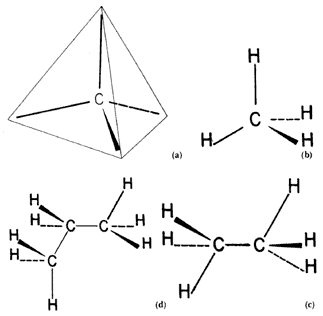
Clases de cadenas carbonadas
Según el tipo de enlace:
1.1 Cadenas Carbonadas saturadas: Son aquellas cadenas en las cual sus átomos están unidos por un solo enlace simple.
1.2 Cadenas carbonadas no saturadas: Son aquellas cadenas en las cuales sus átomos están unidos por un solo enlace simple.
Nota:
* Saturar: Completar con Hidrógenos
* Auto saturar: Completar con Carbonos.
Según por la forma de la cadena:
2.1. Abierta
2.1. Lineal
2.1. Ramificada
.2.2. Cerrada o cíclica
Clases de fórmulas
D.1. Fórmula desarrollada o estructural: Da la ubicación de los números de cada molécula.
D.2. Fórmula Semidesarrollada: Da el tipo de enlace que une a los átomos de carbono y el número de hidrógeno
D.3. Fórmula global o empírica: Da el número de átomos de cada uno de los elementos químicos.
Configuración electrónica
Es el modo en que están ordenados los electrones de un átomo. Los electrones están sujetos al principio de exclusión de Pauli, que dice que los electrones no pueden estar en el mismo estado cuántico a la vez, por lo que, un electrón al ocupar un estado cuántico, el otro electrón debe ocupar otro estado diferente.
Valores de números cuánticos:
Letra Máximo número de electrones S 2 P 6 D 10 F 14 G 18
La distribución electrónica
Es la distribución de los electrones en los subniveles y orbitales de un átomo.
1s2 2s2 2p3 Configuración electrónica de los elementos
Ahora ya podemos utilizar el orden de energías de los orbitales para describir la estructura electrónica de los átomos de los elementos. Un subnivel s puede acomodarse 1 o 2 electrones.
El subnivel p, puede acomodarse

